锂电池用高熵液体电解质
高熵合金/化合物通过引入多种组分而具有较大的构型熵,表现出超越传统材料的改进的功能特性。然而,熵增加如何影响液体的热力学/动力学性质尚不明确。在这里,我们在可充电锂电池的液体电解质中展示了这种策略,展示了通过引入多种盐来提高电解质熵的重大影响。与迄今为止报道的所有液体电解质不同,该电解质中多个阴离子基团的参与导致了溶剂化结构的更大多样性,出乎意料地降低了锂离子和溶剂/阴离子之间的溶剂化强度,促进了锂离子扩散和稳定的相间钝化层的形成。与单盐电解质相比,具有四种盐的低浓度二甲醚电解质表现出增强的循环稳定性和倍率性能。这些发现通过熵主导的溶剂化结构与离子传输之间的基本关系合理化,提出高熵电解质作为锂电池及其他领域的成分丰富且未经探索的空间。
介绍
自 2004 年推出以来,高熵 (HE) 合金因其潜在的理想性能而引起了材料科学和工程领域的广泛关注 1 , 2 ,因为它们具有潜在的理想性能3 , 4 , 5 , 6。已经提出了几种结构、热力学和动力学原理来证明此类材料的特殊性质。首先,几种主要元素(通常超过五种)的存在可以促进固溶相的形成。另一方面,由于构型无序而导致的局部晶格的扭曲可以导致机械性能的提高4。提高 HE 合金功能性能的另一个因素是不同的扩散动力学7,但这一点仍存在争议,因为实验研究很少且复杂,而且知识水平还远未完成8 , 9。
HE 材料类别中的一个新研究方向是液体电解质溶液,它充当电池电极之间的离子传导膜10 , 11。然而,迄今为止,HE 电解质的基本特性尚未得到探索。这激发了人们对主要电解质功能特性如何受到影响的研究,包括氧化还原稳定性、离子电导率、电荷转移和固体电解质界面(SEI)形成。本文的一个重要方面是确定电解质行为的变化是否可以归因于与多种主要成分的存在相关的较大熵,或者归因于主要化学成分本身的性质。通过将多种盐与单一溶剂或/和单一盐与多种溶剂组合,预计会形成更复杂和多样化的溶剂化结构,这是由于溶剂、锂离子和阴离子基团之间局部相互作用的多样性10。这种复杂的溶剂化结构可能会影响氧化还原稳定性、电荷转移以及SEI的组成和结构(图 1a)。这些特性在很大程度上决定了电池的性能参数,例如循环寿命和倍率性能12、13。熵如何影响扩散率和电导率等动力学特性是一个有趣的方面,因为熵仅在形式上与热力学特性相关。然而,对于液体,过量熵标度已被提出,并根据经验证明是系统熵与其动力学行为之间的关系,表明增加熵可以提高扩散率14 , 15,从未探索过电解质。由于能够通过熵调节电解质特性的潜力,以及缺乏这方面的知识,我们开始系统研究 HE 电解质的特性及其对锂电池相关过程的影响。
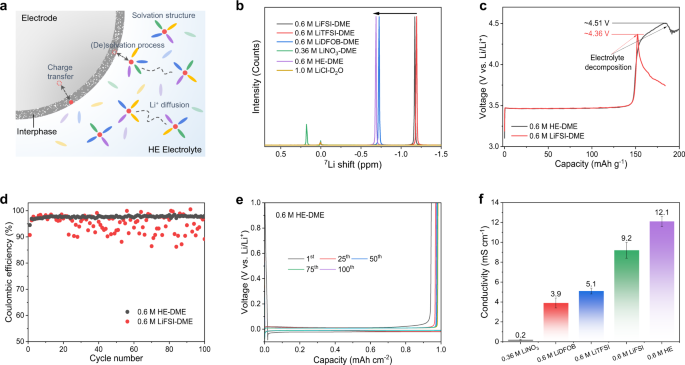
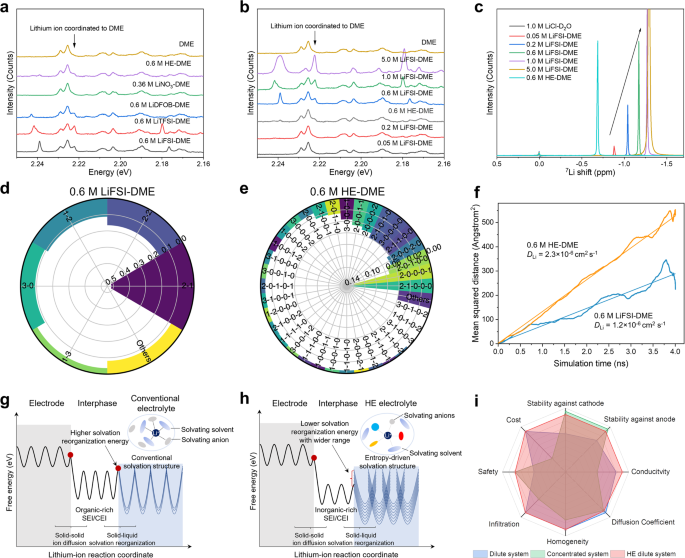
a HE电解质电池系统示意图。b 单盐电解质和所制备的HE电解质的7 Li NMR谱。由于LiNO 3在DME中的盐溶解度相对较低,因此制备了0.36M LiNO 3 -DME电解质用于比较。c使用不同电解质的 Li||LiFePO 4电池在 0.02 C 电流密度下的恒电流充电曲线。 d使用 0.6 M LiFSI-DME 和 0.6 M HE-DME 电解质在 Li||Cu 电池中进行锂电镀/剥离 CE。e 0.6 M HE-DME 电解液的恒电流镀锂/剥离曲线。F不同电解质的锂离子电导率比较。
全尺寸图像
与混合溶剂不同的是,混合溶剂是补偿单个溶剂的缺陷的常见策略,其中引入额外功能溶剂作为相应功能特性的添加剂16、17、18、19、20。在这项工作中,我们通过将 0.15 mol/L (M) 双(氟磺酰基)亚胺锂 (LiFSI)、0.15 M 双(三氟甲磺酰基)亚胺锂 (LiTFSI)、0.15 M 二氟草酸硼酸锂 (LiDFOB) 和 0.15 M 硝酸锂 (LiNO 3 ) 组合在二甲氧基乙烷 (DME) 单一溶剂中,展示了一种原型 HE 电解质。注释1和 补充图 1)。这产生了 0.6 M HE-DME 电解质,将其与具有相同 0.6 M 浓度的每种单盐电解质进行比较。结果表明,在低盐浓度电解质中,更多的阴离子基团可以参与溶剂化结构(类似于高浓度电解质),然而,在这种HE电解质中,锂离子与溶剂和阴离子基团的相互作用要弱得多,这是更高无序性的直接结果,这在任何液体电解质中都从未观察到。结果是在电极上形成富含无机物且稳定的界面层,从而使高压锂电池的循环更加稳定。此外,较弱的溶剂化强度有利于锂离子的迁移率,从而显着提高倍率性能。
结果
电解质的表征以及与阳极的相容性
使用核磁共振(NMR)光谱研究了电解质的锂离子溶剂化环境(图 1b,补充图 2和3)),其中化学位移反映了溶剂化环境对锂离子的屏蔽。0.6 M LiTFSI-DME、0.6 M LiFSI-DME 和 0.6 M LiDFOB-DME 单盐电解质分别导致更多的负移,分别为 -1.19、-1.17 和 -0.73 ppm。在这种情况下,由于电子密度高,锂离子受到相对较强的屏蔽,表明与溶剂和阴离子都有更强的溶剂化相互作用。相比之下,在-0.68 ppm 处观察到 0.6 M HE-DME 电解质的低场偏移,表明锂离子的屏蔽相对较低,这可能基于较弱的溶剂化相互作用来促进锂离子扩散性21。
评估了具有单一盐和不同盐组合的电解质的氧化和还原稳定性(补充图 4-9和补充说明 2)。在单盐电解质中,0.6 M LiFSI-DME表现出最好的整体稳定性,因此在0.6 M HE-DME电解质的详细研究中选择它作为对照组(表1 )。使用截止电压为5.0 V的Li||LiFePO 4电池评估氧化稳定性极限,利用LiFePO 4在~3.8 V以上不存在氧化反应(图 1c ))。0.6 M HE-DME 显示出高达约 4.51 V 的氧化稳定电位,高于单盐(0.6 M LiFSI-DME 为 4.36 V),其中随后的容量增加被认为是由于阴极表面上阴极电解质中间相 (CEI) 的形成。在 4.2 V vs. Li/Li +的极化电位下,由于铝箔的腐蚀受到抑制,0.6 M HE-DME 电解质呈现出稳定的阳极电流,而 0.6 M LiFSI-DME 则遭受铝箔的快速溶解(补充图 10 ))。此外,由于采用 0.6 M HE-DME 的 Li||Cu 电池表现出稳定的锂金属沉积/剥离电压曲线,库仑效率 (CE) 高达 98.6%,大大高于 0.6 M LiFSI-DME(图 1d、 e和补充图 5),因此锂金属阳极还原的稳定性似乎得到了改善(图 1d、e 和 补充图5 )。进行了对称 Li||Li 电池、电化学阻抗 (EIS) 和循环伏安法 (CV) 测量(补充图 11 – 19和补充说明 3),所有这些都表明 0.6 M HE-DME 电解质相对于锂阳极的稳定性得到了改善。
0.6 M HE-DME电解质的锂离子迁移数和电导率的测量(图 1f,补充图 20和补充表 1),结果分别为0.46和~12.1 mS cm -1。这高于 0.6 M LiFSI-DME 电解质的测量值(分别为 0.39 和 9.6 mS cm -1)22。在Li||Li 4 Ti 5 O 12电池中研究了0.6 M HE-DME电解质的倍率性能(补充图 21和22),利用优异的Li 4 Ti 5 O 12率性能和中等工作潜力。当倍率增加到5.0 C时,0.6 M LiFSI-DME电解质的容量保持率下降至约40 mAh g -1,远低于0.6 M HE-DME电解质中 约115 mAh g -1的容量保持率(补充图21)。这种倍率性能的提高与 0.6 M HE-DME 电解质的更高迁移数和电导率直接相关。应该强调的是,0.6 M HE-DME 电解质的电导率高于具有单独盐的电解质的电导率,表明盐的组合导致更高的扩散率。
与阴极的兼容性
在 Li||LiNi 0.8 Co 0.1 Mn 0.1 O 2 (NCM811) 电池(补充图 23)中研究了 0.6 M HE-DME 电解质的氧化稳定性,电压范围为 2.8–4.3 V vs Li/Li +,阴极面积容量为 2.0 mAh cm -2。由于 DME 溶剂的氧化稳定性相对较低,因此截止电压上限对于 DME 溶剂来说是一个挑战。与0.6 M LiFSI-DME电解质结合使用时,Li||NCM811电池在0.1 C的电流密度下无法达到4.3 V的截止电压(图2a )),大概是因为在脱锂(充电) 23时形成的高价镍物质催化下,阴极导致了电解质的不期望的氧化。相比之下,0.6 M HE-DME 电解质在充电至 4.3 V 时显示出显着改善的可逆循环,其中两个可重复的电池提供相似的充电/放电曲线,比容量为 182 mAh g -1 (图 2b和补充 图24 )。还评估了 具有 0.6 M LiDFOB-DME、0.6 M LiTFSI-DME 和 0.36 M LiNO 3 -DME 电解质的 Li||NCM811 电池(补充图25 – 28))。具有 0.6 M LiDFOB-DME 电解质的电池可充电至 4.3 V,产生约 20 个循环,随后在 50 个循环后快速衰减至初始容量的约 30%(补充图 25 和 28),这与在 Li||Cu 电池中观察到的连续电解质和锂消耗 24类似(补充图6 )。0.36 M LiNO 3 -DME 电解质根本不支持循环(补充图 27)。上述结果表明0.6 M HE-DME电解液显着提高了NCM811正极的氧化稳定性。在 Li||NCM811 电池中评估倍率性能(图 2c、d和补充图 29 ))。当在6.0 C(1080 mA g -1 )下充电时,实现了超过60%的容量保持(图 2d),同时相应的充电/放电曲线保持可比,反映了稳定的循环。Li||NCM811电池中0.6 M HE-DME电解质的循环性能测试在0.333 C下进行(图 2e,补充图 30和31),充电至4.3 V 100次循环后容量保持率超过82%。当充电截止电压降低至4.2 V时,获得超过90%的增强容量保持率,表明与二甲醚。LiFePO 4进一步证明了这一点正极在2.5-3.8 V下循环,500次循环后容量保持率超过95%,这意味着在合适的电压范围内,与0.6 M LiFSI-DME电解质相比,0.6 M HE-DME电解质形成了更稳定的界面(图2f和补充 图32 )。
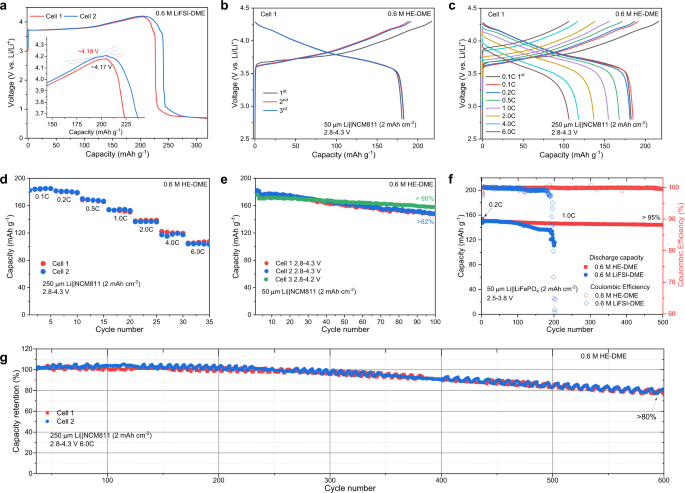
a、b LiNi 0.8 Co 0.1 Mn 0.1 O 2 (NCM811) 电池在 0.6 M LiFSI-DME、b 0.6 M HE-DME电解质中的恒电流充电/放电曲线,电压范围为 2.8–4.3 V,速率为 0.1 C (1 C = 180 mA g −1 )。使用容量为2 mAh cm -2的NCM811和50 μm锂金属箔测试电池,得到5的负/正容量比(N/P)。NCM811电池在0.6 M HE-DME电解质中以不同倍率进行的恒电流充电/放电曲线。d NCM811 在 0.6 M HE-DME 电解液中的电化学倍率性能。e NCM811 在 0.6 M HE-DME 电解质中的循环性能,以 0.1 C 速率循环三个循环,然后在不同电压范围下以 0.333 C 速率循环。f LiFePO 4 (LFP) 电池的循环性能,以 0.2 C 速率循环三个周期,然后以 1.0 C 速率循环。g NCM811 电池在 0.6 M HE-DME 电解质中以 6.0 C 速率循环的长期循环容量保留率。
全尺寸图像
作为功率密度和循环寿命的最终测试,在 Li||NCM811 电池中以 6.0 C 的侵蚀速率进行 0.6 M HE-DME 电解质的长期循环(图 2g,补充 图29 和33 )。500 次和 600 次循环后,容量保持率分别达到约 85% 和 80%。将循环速率从0.333 C增加到6.0 C将CE从99.3%增加到99.8%,表明较短的高电位暴露在一定程度上减少了DME的界面反应。在6.0 C下长期循环1000次后,可以以0.5 C的速率恢复 超过155.0 mAh g -1的容量(补充图33 ))。这些结果进一步支持 DME 是导致高压阴极容量衰减的原因,但在这种 HE 电解质中混合几种盐显示出显着的改进和有希望的应用潜力。
锂金属沉积物的形貌和微观结构
为了确定HE-DME与锂金属阳极组合电化学性能改善的根源,用扫描电子显微镜(SEM)研究了镀在裸铜箔上的锂金属的形态(图3a-d和补充 图34-38 )。0.6 M HE-DME 电解液中沉积的锂金属是致密的,并且与粒径为 10 µm 量级的 Cu 基底良好连接(图 3a、b 和补充 图34 )。相比之下,对于 0.6 M LiFSI-DME 电解质,观察到多孔和树枝状锂沉积物与铜基板的连接不太好(图 3c、d和补充图 35 )),这可能是剥离后残留枝晶锂的原因(补充图 36)。对于0.6 M HE-DME电解质,剥离后的铜基板显示出较少的残留锂金属(补充图 37、38和补充说明 4 )。利用原位电化学原子力显微镜(AFM)进一步研究了锂金属沉积过程(补充图 39-41和补充说明 5 ),其中0.6 M HE-DME电解质中沉积的锂金属颗粒相对较大,形成更致密的形态。
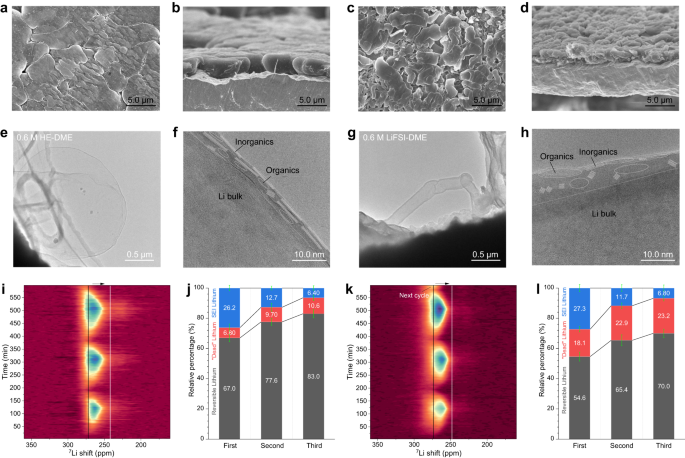
0.6 M HE-DME 电解液电镀后的锂金属形貌a、b ;c、d为 0.6 M LiFSI-DME 电解液。a、c顶视图;b和d剖面图。0.6 M HE-DME 电解质的冷冻 TEM 图像e、f中沉积的锂金属和界面相的微观结构;g , h为 0.6 M LiFSI-DME 电解质。f和h的放大图像显示在补充图中。 46和47。操作图 7 0.6 M HE-DME 电解质的 Li 固态 NMR 谱和锂物质i、j的定量;k、l为 0.6 M LiFSI-DME 电解液。SEI 中的锂物质(蓝色条)、可逆锂金属(灰色条)和“死”锂金属残留物质(红色条)源自锂金属积分强度比 I(剥离)/ I(电镀)和CE。误差线是通过不同的测试获得的。Cu||LiFePO 4电池在不同电解质下相应的恒电流充电/放电曲线如补充图60所示 。
全尺寸图像
冷冻透射电子显微镜(cryo-TEM)用于评估0.6 M HE-DME和LiFSI-DME电解质中的 锂金属和SEI结构25 (图3e-h)。在0.6 M HE-DME电解质中,观察到具有薄SEI(约6 nm厚)的大锂金属颗粒(图3e ,f和补充图 42-44 ) ,这与0.6 M LiFSI-DME电解质中具有较厚且不均匀SEI层的晶须和针状锂金属沉积物不同(图3g,h和补充 图43 和45 ))。由于以无机为主,这表明更多的阴离子基团参与了 0.6 M HE-DME 电解质的 SEI 形成(图 3f和补充图 46)。而对于 0.6 M LiFSI-DME 电解质,形成马赛克结构的 SEI,主要是 DME 溶剂分解(图 3h和补充图 47)。选区电子衍射 (SAED) 和高分辨率 TEM 成像(补充图 48)表明,这些电解质中的锂金属生长是不同的。在 0.6 HE-DME 电解质中,观察到大的球形微晶,(110) 平面平行于 Cu 基底(补充图 48a、c)。这与之前的研究一致,该研究表明这种晶体织构有利于提高锂生长的均匀性26。这意味着成核后,锂离子传输促进了0.6 HE-DME电解质中规则且均匀的锂金属生长。这似乎不适用于 0.6 M LiFSI-DME 电解质,其中颗粒本质上是多晶的(补充图 48b 和 d)。冷冻扫描透射电子显微镜 (STEM) 电子能量损失光谱 (EELS) 绘图也揭示了 SEI 中非常不同的元素分布(补充图 49和50))。在0.6 M HE-DME电解液中,外表面富含O,而F、S、N和B均匀分布在颗粒表面(补充图 49和50)。然而,对于0.6 M LiFSI-DME电解质,部分外表面富含C和O,并且整体C的存在量要丰富得多。使用 X 射线光电子能谱 (XPS) 进一步研究 SEI 成分(补充图 51 – 59和补充说明 6),其中 O 1s、F 1s 和 N 1s 光谱证实无机 Li-F、Li-N、BF、Li-O 和 BO 物质在 0.6 M HE-DME 电解质中的 SEI 中占主导地位。这些物质的存在可能导致锂离子供应更加容易和均匀,支持致密的锂金属生长27,并减少 0.6 M LiFSI-DME 电解质中溶剂物质的分解。
Operando 固态7 Li NMR 用于确定两种电解质中电镀/剥离过程中锂损失的来源28(补充说明 7)。为了实现定量,采用无阳极Cu||LiFePO 4全电池配置29、30。正如预期的那样,7 Li 金属共振在循环前不存在,并在电镀时出现,约为 260-270 ppm(图 3i,k),充电后达到最高积分强度。随后,强度在放电(锂剥离)过程中降低,留下一些强度,这代表“死”或不活跃的锂金属。来自操作7计算前三个循环的 Li NMR 谱和 CE、SEI 中可逆锂金属、死锂金属和锂的分数31并显示在图 3j、l中。在第一次循环期间,两种电解质在 SEI 形成中都有类似的锂损失,然而,0.6 M HE-DME 电解质中的“死”锂金属部分较小,这有助于观察到该电解质具有较高的 CE(图 3i,j )。在第二次和第三次循环期间,两种电解液中“死”锂金属的比例均有所增加(补充图 61),0.6 M LiFSI-DME 电解液中的“死”锂金属比例更高,这导致“死”锂金属比例增加了 2.4 倍。在每个电镀过程结束时,7与 0.6 M LiFSI-DME 电解质中的锂金属共振相比,0.6 M HE-DME 电解质中的 Li 金属共振移动到更低的 ppm 值。它在~246 ppm 时达到接近锂金属箔的值30,这表明 0.6 M HE-DME 电解质产生更致密的锂金属形态31、32,与上述 SEM 观察结果一致。
正极电解质界面的形貌、微观结构和组成
为了了解 NCM811 正极在 0.6 M HE-DME 电解质中的稳定循环,研究了 CEI 的形态、微观结构和成分。循环后,当比较循环前后拍摄的 SEM 图像时,阴极颗粒的形态(其中二次颗粒由致密堆积的初级亚微米尺寸颗粒组成)保留在 0.6 M HE-DME 电解质中(补充图 62 )。在-170 °C 下进行冷冻 TEM,以研究颗粒表面形成的空气敏感 CEI 的纳米结构和化学成分。与原始材料(补充图 63)相比,循环后形成了厚度在6-11 nm范围内的共形CEI层(图 4a,b),和补充图 64)。NCM811颗粒近表面区域相应的快速傅里叶变换(FFT)模式表明原始层状结构在很大程度上得到了保留(补充图64 )。在室温下从循环的 NCM811 电极收集原子分辨率高角度环形暗场 (HAADF) 和环形明场 (ABF)-STEM 图像。在 HAADF 和 ABF 图像中,在 NCM811 颗粒表面观察到约 2 nm 的混合 Li/TM(TM:过渡金属)层(图 4c、d),这表明在碳酸盐电解质中观察到了向岩盐相的有害 相变33,在 0.6 HE-DME 电解质中循环最多 50 次也没有发生。记录 Cryo-STEM EELS 图以研究 CEI 层中的元素分布和循环阴极的近表面结构(图 4e和补充图 65)。结果表明,共形CEI层中存在含O、C、F和N的成分,其中O、C和F是参与CEI形成的主要成分,N均匀分布在颗粒表面(图4e和补充 说明8 )。
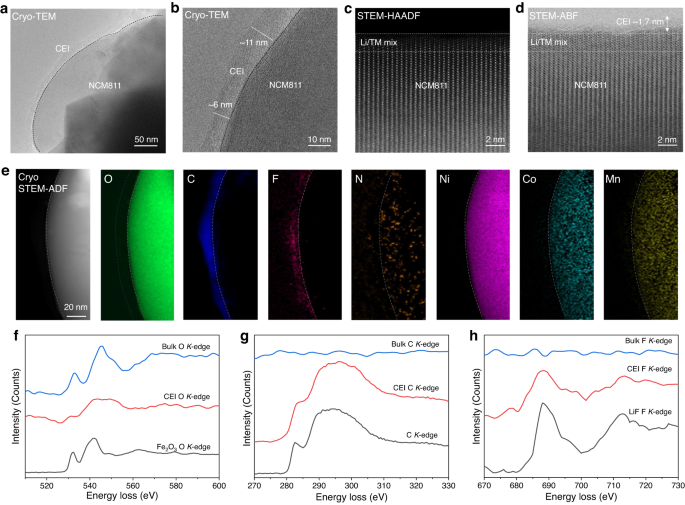
a、b在 0.6 M HE-DME 电解质中循环后 CEI 的冷冻 TEM 图像。c在室温下收集的原子分辨率高角度环形暗场 (HAADF) 和d环形明场 (ABF) 扫描透射电子显微镜 (STEM) 图像。在HAADF和ABF图像中,在颗粒表面附近都观察到了厚度约为2 nm的Li/TM(TM:过渡金属)混合层,此外,利用其检测轻元素的能力,在ABF图像上发现了约1.7 nm的层。e NCM811 CEI 的冷冻 STEM 电子能量损失谱 (EELS) 绘图,包括冷冻 STEM ADF 图像以及 O、C、F、N、Ni、Co 和 Mn 元素图。比例尺为 20 nm。EELS精细结构f , O K -边缘在块体和 CEI 中包含 Fe 2 O 3作为参考;g C K - 整体边缘和以碳为参考的 CEI;块体中的h F K边缘和以 LiF 作为参考的 CEI。
全尺寸图像
O K边缘、C K边缘和 F K边缘处的 EELS 精细结构提供了对 CEI 和本体 NCM811 成分的进一步了解(图 4f-h)。与参考的Fe 2 O 3的 O K边缘相比,阴极体中约 533 和 544 eV 处的O (2 p )-TM (3 d ) 杂化峰能量相对较高。CEI层中的O显示出类似于有机聚合物碳酸酯组合物34(图 4f )的键合,这很可能是DFOB分解的结果35。C K的峰值约为 290 eV边缘EELS光谱,进一步支持了CEI层中碳酸酯键的形成(图 4g)。最后,F K边缘 EELS 表明 CEI 层中存在 LiF(图 4h)。XPS深度剖析分析进一步证实了元素分布的这些观察结果,表明O和F是0.6 M HE-DME电解质中形成的CEI层中的主要物种(补充图66-73 和补充说明9 )。该成分分析表明,在 0.6 M HE-DME 电解质中形成的 CEI 由支持高稳定性和高电导率的成分组成。
HE电解液中的溶剂化结构
使用拉曼光谱研究单盐和 HE-DME 电解质的溶剂化结构(图 5a和补充图 74-76)。与单盐电解质相比, HE-DME 电解质显示出锂离子和 DME 溶剂之间的溶剂化相互作用较弱,这由 ~2.22 eV 36 , 37处的峰强度降低表明(补充图76)。在 0.36 M LiNO 3 -DME 电解质中,该峰也显得较弱,在这种情况下,这应归因于 LiNO 3在 DME 38中的溶解度差,其中强 Li + -NO 3 -与 HE-DME 电解质相比,相互作用导致电导率较低(补充表 1)。与不同浓度的LiFSI-DME电解质(图 5b和补充图 75和76)相比,0.6 M HE-DME电解质中的溶剂化与稀电解质(0.2 M和0.05 M)中的溶剂化最相似。这也与浓电解质(5.0 M) 39、40中阴离子和锂离子之间的强相互作用有很大不同。与此相适应,70.6 M HE-DME 电解质的 Li 化学位移表明屏蔽较弱,因此溶剂化较弱;甚至比稀释的 0.05 M LiFSI-DME 电解质更弱(图 5c)。
a单盐和HE电解质的拉曼光谱。b不同LiFSI浓度DME电解质的拉曼光谱。HE-DME 电解质和 DME 电解质中的 LiFSI 的c 7 Li NMR 谱,参考 D 2 O 溶液中的 1 M LiCl。d 0.6 M LiFSI-DME 电解质和 e 0.6 M HE-DME 电解质的 锂离子配位环境通过 MD 模拟确定(详细描述见补充表2和3)。f锂离子自扩散系数 ( D Li)来自 0.6 M LiFSI-DME 电解质(蓝线)和 0.6 M HE-DME 电解质(橙线)的 MD 模拟均方位移。g , h示意图,说明g常规电解质和h 0.6 M HE 电解质中电极和电解质之间的离子传输。i HE电解液与传统稀电解液和高浓度电解液的性能比较。
全尺寸图像
HE电解质引入了阴离子种类的多样性,这反过来预计会导致更多种类的溶剂化结构,削弱锂离子和DME/阴离子之间的相互作用,如上面从NMR推断的那样。为了更深入地了解溶剂化结构,进行了密度泛函理论(DFT)和分子动力学(MD)模拟(补充图 77,补充表 2和3)。0.6 M HE-DME 电解质中的各种主要阴离子种类导致 30 多种类型的锂离子溶剂化环境的丰富多样性,远远超过 0.6 M LiFSI-DME 电解质的预测(图 5d、e 和补充 图78 和79 ))。模拟的自扩散系数为2.3 × 10 -6 cm 2 s -1大于0.6 M LiFSI-DME电解质的自扩散系数(图 5f),表明锂离子迁移率得到改善,与测量的电导率一致(图 1f和补充表 1)。
讨论
MD模拟表明,与具有相同盐浓度的单盐电解质相比,在HE电解质中引入多种盐会导致溶剂化结构的多样性更大,表现出更高的熵,并导致更高的锂离子迁移率。Rosenfeld 14于 1977 年提出了一种定义熵与液体动态特性之间关系的方法,该方法被称为过量熵标度,这是一种近似的半定量关系,目前广泛用于估计液体的动态特性,例如扩散常数和热导率15。一般来说,过度熵标度表明扩散率随着系统熵的增加而增加。它可以为目前的观察提供定性论证,其中通过引入多种盐来增加熵(导致溶剂化结构的更丰富的变化)导致扩散率和电导率的增加,同时保持总盐摩尔浓度相同。直观的解释是,增加电解质中主要成分的数量将导致基于溶剂化结构更广泛的多样性的扩散势垒的更广泛分布。早期研究表明,在规则晶格中,与均匀能垒相比,扩散能垒的随机分布通常会增强三维扩散,41 .
液体电解质的溶剂化结构在电解质和电极之间的电荷转移以及SEI形成中起着主导作用,其中所产生的SEI形态和组成决定了锂离子通过SEI的传输。根据 MD 模拟获得的 0.6 M LiFSI-DME 电解质的径向分布函数 (RDF)(补充图 80),与其他元素相比,氧表现出强烈的与锂离子配位的倾向,表明锂离子和溶剂分子之间存在相对较强的相互作用。然而,在HE-DME电解质中,氟和氮也与锂离子配位,表明更多的富含阴离子的溶剂化结构。这合理化了以下观察结果:对于 HE 电解质,阳极上的 SEI 和阴极上的 CEI 都富含分解的盐阴离子。这些盐阴离子负责更高的电化学稳定性,促进电解质和 SEI/CEI 之间的锂离子转移42 , 43而且 SEI 和 CEI 中的锂离子电导率很可能也更高。至于 SEI-电解质界面,HE 电解质中溶剂化结构的巨大多样性导致更广泛的溶剂化能,如 DFT 所示(补充图 81 )。这种多样性导致较低的溶剂化重组能,从而促进锂离子扩散以及电荷向界面转移,如图 5g、h所示。补充图82进一步说明了熵主导和传统稀电解质中的去溶剂化过程 。在HE电解质中,尽管HE电解质浓度较低,但混合熵的增加导致了富含无机物的SEI/CEI和改进的锂离子动力学,从而导致更致密的锂金属生长。基于上述结果,传统稀电解液、高盐浓度电解液和HE电解液的特性比较如图 5i所示。从这个比较中,HE展示了有前途的资产,特别是意识到它能够提高低盐浓度液体电解质中阳极/阴极的稳定性,这通常可以在高浓度电解质中实现(补充图83 )。
总之,我们提出了具有多种盐的液体电解质,并研究了熵在此类材料中的作用和影响。通过引入多种盐(例如LiFSI、LiTFSI、LiDFOB和LiNO 3)在醚溶剂中,制备了 HE 电解质以进行概念验证,该电解质对锂金属电镀/剥离表现出更高的可逆性,并且对富镍阴极充电至高截止电压具有更高的氧化稳定性,从而提高倍率性能。尽管 DME 的盐浓度较低(0.6 M)且氧化稳定性较差,但高熵赋予该溶液具有良好的电解质性能。结果表明,与单盐电解质相比,更多的盐阴离子参与低浓度 HE 电解质的溶剂化结构,从而产生更薄且富含无机物的 SEI。改进的相间特性增强了阳极和阴极电化学稳定性(补充图 84),使得4V级锂电池的锂金属镀层更加致密,醚类溶剂的氧化稳定性更高。这使得充电/放电循环的可逆性得到改善,倍率性能也优于传统电解质。此外,与通常的单盐低浓度和高浓度电解质相比,观察到的锂离子与溶剂/阴离子之间的溶剂化强度较弱,这被认为是增强电荷转移和改善电解质电导率的原因。这是混合熵增加的结果,导致 HE 电解质中溶剂化重排更加多样化和容易(补充图 82和83)。
HE 材料的成分范围很广,因为溶剂和盐的化学性质和相对含量可能各不相同。目前的研究表明,通过引入多种盐来提高熵可用于通过溶剂化结构来改善其功能特性,其中特定盐和溶剂的选择应根据它们与特定阳极和阴极化学的相互作用来指导。通过制备支持更长稳定循环的五组分盐 HE 电解质进一步支持了这一点(补充图 85 – 87和补充说明 10)。这一探索激发了更基础、更系统的研究,具有普遍的科学重要性,并将指导更好的电解质系统及其他系统的发展。
方法
材料与合成
锂金属箔(厚度为250μm)、铜箔和铝箔购自MTI公司,锂金属箔(50μm)购自中国能源锂业有限公司。所有锂金属箔在使用前用二甲氧基乙烷(DME)溶剂洗涤3次。将铜箔在稀醋酸中浸泡几分钟,然后分别用去离子水和丙酮清洗3次,然后在手套箱真空干燥箱中在室温下快速干燥。DME 溶剂购自 Sigma-Aldrich,并用 4 Å 分子筛(Sigma-Aldrich)脱水以除去可能的微量水。双(氟磺酰基)亚胺锂(LiFSI)、双(三氟甲磺酰基)亚胺锂(LiTFSI)、二氟(草酸)硼酸锂(LiDFOB)获自Sigma-Aldrich,双(五氟乙磺酰)亚胺锂(LiBETI)购自3M公司,购买后在80℃真空条件下干燥24h。硝酸锂(LiNO3 , > 99.9%) 购自深圳市新宙邦科技有限公司并按原样使用。所有电解质均通过在充满Ar的手套箱中将特定量的不同锂盐溶解在DME溶剂中来制备(H 2 O < 0.1 ppm,O 2 < 0.1 ppm)。0.6 mol L -1 (M) LiFSI-DME、0.6 M LiTFSI-DME、0.6 M LiDFOB-DME 和 0.36 M LiNO 3 -DME 电解质表示不同浓度的盐溶解在 DME 中,其中 0.6 M LiNO 3 -DME 电解质由于盐溶解度相对较低而无法制备。HE-DME电解质通过溶解0.15 M LiFSI、0.15 M LiTFSI、0.15 M LiDFOB和0.15 M LiNO 3制备将0.15 M LiFSI、0.10 M LiTFSI、0.10 M LiBFTI、0.10 M LiDFOB和0.15 M LiNO 3溶解于DME溶剂中,锂总浓度为0.6 M,制备五组分0.6 M HE-DME电解液。
LiFePO 4获自Leneng Technology,其正极通过将LiFePO 4材料、聚偏二氟乙烯(PVDF、MTI)粘合剂和Super P(Alfa Aesar)导电碳以92:4:4的重量比混合来制备。将所得浆料浇铸在铝箔上,然后在 60°C 下干燥 6 小时,然后在真空烘箱中在 120°C 下干燥过夜。Li 4 Ti 5 O 12阳极原样购自MTI Corporation。采用共沉淀法合成了LiNi 0.8 Co 0.1 Mn 0.1 O 2 (NCM811)。一定量的碱性水溶液(NH 4将OH和NaOH倒入去离子水(1.5L)中,在连续搅拌下在罐式反应器中形成碱溶液。然后,将摩尔比为 8:1:1 的 NiSO 4 ⋅ 6H 2 O、CoSO 4 ⋅ 7H 2 O 和 MnSO 4 ⋅ H 2 O 的 2 M 溶液以及 5 M NH 4 OH 和 10 M NaOH的水溶液以 8 mL min -1的稳定速率添加到罐式反应器中的基础溶液中。共沉淀温度控制在50℃,氮气气氛下用NH 4 OH维持pH值在11左右,搅拌速度500rpm。共沉淀Ni 0.8 Co制备0.1 Mn 0.1 (OH) 2前驱体,随后用去离子水和乙醇洗涤四次,并在120℃下真空干燥24小时。Ni 0.8 Co 0.1 Mn 0.1 (OH) 2前体的表观密度和振实密度分别为1.88 g cm -3和2.06 g cm -3。为了制备NCM 811材料,将所得前体与LiOH·H 2混合O摩尔比为1:1.03;然后首先在500℃下加热5小时,然后在氧气气氛中在780℃下煅烧12小时。自然冷却后,将所得材料直接放入充氩手套箱中以防止水分暴露。NCM811电极的制备方法是将活性材料、Super P和PVDF粘合剂以90:5:5的质量比在N-甲基-2-吡咯烷酮(NMP)溶剂中混合,并浇铸在铝箔上,然后在60℃下干燥6小时,然后在120℃真空烘箱中干燥过夜。X 射线衍射图显示了所制备的 NCM811 材料的纯相。
电化学测量
所有电池的电化学循环测试均基于在充满 Ar 的手套箱中组装的 CR2032 纽扣电池(H 2 O < 0.1 ppm,O 2 < 0.1 ppm),除非另有说明,否则使用 Celgard 2500 分离器并在室温下进行测试。将 70 μL 电解液注入每个纽扣电池中进行比较。所有纽扣电池均使用多通道电池测试系统(Land CT2001A 或 Lanhe G340A)在室温下进行测试。组装对称Li||Li电池,研究不同电解质在不同电流密度下的循环稳定性。工作电极和对电极均使用直径 15.6 毫米、厚度 250 微米的锂金属箔。对于锂铜电池,使用14毫米直径的锂金属箔作为参比,而使用16毫米铜箔作为工作电极,锂沉积的有效面积为1.54 cm 2。循环期间,容量为1 mAh cm -2以0.5mA cm -2的电流密度将锂沉积在Cu箔上,然后剥离至相对于Li/Li + 1.0V的截止电压。
LiFePO 4和NCM811电极(直径12mm)的电化学循环性能均以厚度为50μm的锂金属箔作为对电极以2mAh cm -2的面积容量进行测试。Li||NMC811电池在0.1 C速率下在2.8和4.3 V之间电化学循环三个循环,然后以0.333C速率(1 C = 180 mA g -1 )循环。Li||LiFePO 4电池在恒电流模式下循环,而2.5-5.0 V的电压范围用于测量不同电解质的氧化稳定性,其中LiFePO 4 阴极不显示从Fe 2+到Fe 3+的额外氧化还原反应高于〜3.8 V。对于Li||Li 4 Ti 5 O 12和Li||NMC811电池的电化学倍率性能, Li 4 Ti 5 O 12(12mm直径)的面积容量为2mAh cm -2 ,NMC811的面积容量为2mAh cm -2,厚度为250μm的锂金属箔作为对电极。以 0.8 mV s -1的扫描速率对不同电解质的 Li-Cu 电池进行循环伏安法 (CV),相对于 Li/Li +从 -0.1 到 2.5 V。在 Autolab (PGSTAT302N) 上收集对称细胞的电化学阻抗谱 (EIS),频率范围为 0.1 Hz–1 MHz,电位幅度为 10 mV。
电解质的锂离子迁移数(t Li +)通过Abraham等人的方法测量。7 . 使用 HE-DME 电解质对对称 Li||Li 电池使用 10 mV 的极化电位 (Δ V ),直到极化电流达到稳定状态。在极化之前和之后收集相应的 EIS 测量结果。t Li +使用以下等式计算:( 1 ):
$${t}_{{{Li}}^{+}}=\frac{{I}^{{{{{{\rm{ss}}}}}}}{R}_{b}^{{{{{{\rm{ss}}}}}}}(\varDelta V-{I}^{0}{R}_{i}^{0})}{{I}^{0}{R}_{b}^{0}(\varDelta V-{I}^{{ {{{{\rm{ss}}}}}}}{R}_{i}^{{{{{{\rm{ss}}}}}}})}$$(1)
其中 Δ V是施加的电势,I 0是初始电流,I ss是稳态电流;R b 0和R b ss是体电阻的初始值和稳态值,R i 0和R i ss分别是界面电阻的初始值和稳态值,通过恒电位极化之前和之后的阻抗测量来检查。
使用对称不锈钢电池通过收集室温下的电化学阻抗( R )来测量电解质的离子电导率,并使用等式1进行计算。(2):
$$\sigma=\frac{L}{R\times S}$$(2)
其中σ是离子电导率,S是电极的有效面积,L分别代表两个不锈钢电极之间的厚度。测试电池在两个电极之间装有聚四氟乙烯 (PTFE) 环。因此,电极的有效面积是根据PTFE环的内径计算的,两个不锈钢电极的厚度是根据PTFE环的总厚度计算的。
为了评估 Al 箔腐蚀,将 Al||Li 电池与 250 µm 厚的锂金属箔和 70 µL 不同种类的电解质组装在一起。在 4.2 V vs. Li/Li +的恒电位模式下对电池进行24 小时测试。
材料表征
在冷场扫描电子显微镜(SEM、HITACH-S4800、SU8010)上测量电极的形貌。使用单色 Al Kα X 射线源,通过 X 射线光电子能谱(XPS,PHI 5000 VersaProbe II)分析电极表面的元素组成,X 射线设置为 100 µm 25 W 15 kV。使用针对碳 (284.8 eV) 校准的 MultiPak 软件拟合峰。上述形态和成分表征是在充满Ar的手套箱中经过特定循环后拆卸电池并用纯DME溶剂冲洗3次以去除残留电解质,然后在手套箱中在室温下干燥几个小时以去除残留溶剂来进行的。然后将这些电极转移到真空转移箱中进行测量,以避免暴露在空气中。拉曼光谱通过配备奥林巴斯BX显微镜和氩离子激光器(532nm)的微型激光共焦拉曼光谱仪(Horiba LabRAM HR800光谱仪)在室温下测量。在测量之前,将所有电解质密封在手套箱中的石英比色皿中。使用配备 Cu Kα 辐射源(λ1 = 1.54060 Å,λ 2 = 1.54439 Å(40 kV 和 40 mA)和 LynxEye_XE 探测器。
冷冻透射电子显微镜 (cryo-TEM) 表征
传统和冷冻(S)TEM 实验是在扫描透射电子显微镜(STEM)(JEM-ARM300F,JEOL Ltd.)上进行的,该显微镜在 300 kV 下运行,配有冷场发射枪和双 Cs 校正器。在图像采集过程中,记录了相应的电子剂量通量(每秒每平方埃的电子数单位,e − Å -2 s -1 )。传统 STEM 图像的拍摄剂量率超过 1000 e − Å −2 s −1每张图像的曝光时间为几秒钟。使用 OneView 和 K2 相机获得冷冻 TEM 图像,每张图像的曝光时间约为 0.3 秒,并具有内置漂移校正功能。冷冻 TEM 图像的电子剂量率为 50–500 e − Å −2 s −1。使用短曝光单帧照片来估计散焦并使其尽可能接近谢尔泽散焦。EELS 光谱是在色散为 1 eV/通道的 GIF Quantum 相机上采集的,利用双 EELS 功能来校正以零损耗峰值为中心的低损耗和以 C 为中心的磁芯损耗的漂移。K 边。EELS 光谱图像是使用长度为 20 mm 的相机和 10 ms 的像素停留时间拍摄的。通过将每个像素处的零损耗峰值集中到 0 eV 来校正光谱成像期间的能量漂移。通过双窗口方法计算元素图,其中前边缘窗口适合幂律背景,后边缘窗口针对磁芯损耗信号 50-200 eV。光谱分析是在 Gatan 显微镜套件软件中进行的。对于冷冻 TEM 样品制备和转移,循环后立即在充满氩气的手套箱中拆卸电池,然后用纯 DME 冲洗锂金属阳极和 NCM811 阴极 3 次以去除锂盐,然后在手套箱中在室温下干燥 1 小时以去除残留溶剂。在洗涤过程中,
对于锂金属阳极的低温 TEM 制备,将蕾丝碳 TEM 网格放置在铜箔工作电极上,并在充氩手套箱中组装成锂铜电池。电池以1.0 mA cm -2的恒定电流密度放电15分钟,然后拆开电池取出TEM网格进行测量。将 TEM 网格小心地转移到手套箱中的冷冻 TEM 支架中,并配有专门的百叶窗,以防止空气暴露和冰凝结到样品上,从而引入任何副反应。将冷冻 TEM 支架转移到 TEM 柱中后,使用液氮将温度保持在 -170 °C 左右。对于 NCM811 阴极的冷冻 TEM 制备,传统的 LiǁNCM811 电池在 2.8–4.3 V 的电压范围内于 0.333 C 下循环 50 个循环,然后在手套箱中拆卸。冲洗阴极后,将一小块阴极密封在内部装有纯DME的密闭容器中。然后从手套箱中取出密封的气密容器,通过超声波法将样品分散三分钟。在那之后,将分散的阴极掉落在手套箱中的 TEM 网格上,然后装入冷冻 TEM 支架中以进行进一步测量。还使用相同的专用快门来防止空气暴露。所有冷冻 TEM 图像均在 −170 °C 左右拍摄,以减少光束损坏。对于传统的STEM实验,将上述分散的样品滴在铜网上,在真空中干燥三个小时,然后装入双倾斜支架中。STEM-HAADF 和 ABF 图像在室温下记录。在真空中干燥三个小时并装入双倾斜支架中。STEM-HAADF 和 ABF 图像在室温下记录。在真空中干燥三个小时并装入双倾斜支架中。STEM-HAADF 和 ABF 图像在室温下记录。
原位原子力显微镜 (AFM) 表征
原位电化学 AFM 测量(Bruker Corporation)使用由电化学工作站(CHI760E)供电的三电极电池在充氩手套箱(H 2 O < 0.1 ppm,O 2 < 0.1 ppm)中进行。使用铜基板作为工作电极和锂金属条作为对电极和参比电极来组装电池。在电化学测量过程中,电池以0.5 mA cm -2的恒定电流密度放电,其中在不同时间收集锂电镀过程的图像。使用峰值力敲击模式和 ScanAsyst-Fluid 尖端 ( k = 0.7 N m −1)用于其卓越的力控制,尖端和电极之间的力为 pN 级,从而减少了液体条件下对样品表面的损坏。使用 NanoScope 分析软件对获得的 AFM 图像进行分析。
液体核磁共振 (NMR) 表征
液体核磁共振谱是在室温下使用安捷伦 400 MHz DD2 NMR 波谱仪和 5 mm ONE NMR 探头记录的,其工作频率分别为 7 Li 155.5 MHz、13 C 100.6 MHz和19 F 376.49 MHz。化学位移值以 ppm 为单位给出。7 Li 化学位移参考标准溶液:1 M LiCl 的 D 2 O 溶液,用于7 Li (0 ppm)。将外标溶液密封到 WILMAD 同轴插入管中,然后插入装有电解质的 5 mm KONTES 管中,并用 PTFE 盖密封。Mestrelab Research Mnova 软件用于数据处理。
固态核磁共振表征
Operando 固态 NMR 测量是在配备 NEO 控制台的大口径 Bruker Ascend 500 系统上进行的,磁场强度为 11.7 T,7 Li共振频率为 194.37 MHz,使用螺线管镀银铜线圈。静态操作7Li NMR 测量是在室温下使用自动调谐和匹配探针(ATM VT X operando WB NMR 探针,NMR Service)进行的,这可以在操作电化学实验期间自动重新校准 NMR 射频 (rf) 电路。将带有低通滤波器的高度屏蔽线连接到探针上进行电化学测量,这可以最大限度地减少 NMR 和电化学电路之间的干扰。采用 4 μs 的 π/2 脉冲和 1.0 s 的循环延迟的单脉冲来获取一维静态光谱。每次使用T 1的三倍的回收延迟,其中T 1使用饱和恢复实验确定。电化学电池由 Maccor 电池测试系统同时控制。由聚醚醚酮 (PEEK) 制成的塑料胶囊池用于操作核磁共振实验。使用LiFePO 4阴极(面积容量为2.0 mAh cm -2)和Cu箔作为工作电极和反电极以及一块Celgard和一块玻璃纤维(Whatman GF/A)作为隔膜来组装电池。测量前,将组装好的电池在手套箱中静置 2 小时。将操作胶囊电池排列在镀银的铜线圈中,其中 LiFePO 4和铜箔电极垂直于B 0并平行于B 1定向射频场。在静态7 Li NMR测量期间,将电池在0.5mA cm -2的电流密度下充电至1mAh cm -2的容量。将1mAh cm -2的充电截止容量用于Cu箔上的锂金属镀敷,并使用2.0V的放电截止电压进行剥离。在充放电过程中,连续获取核磁共振谱。7 Li的化学位移参考 0 ppm 的 1 M LiCl 水溶液。使用自动相位和基线校正在 Bruker Topspin 软件中处理光谱。Mestrelab Research Mnova 软件用于数据处理和分析。
分子动力学 (MD) 模拟
使用 LAMMPS 包44对具有不同锂盐和浓度的单一电解质和 HE 电解质系统进行 MD 模拟。分子和离子通过液体模拟全原子 (OPLS-AA) 力场的优化势来描述45。通过使用 Møller-Plesset 二阶微扰法和相关一致的极化价 cc-pVTZ(-f) 基组 46 拟合原子中心的分子静电势来计算部分电荷。为了在 DME 中产生一定浓度的盐,需要 1:10 的盐/溶剂比。使用 Packmol 47软件在尺寸为 60 × 60 × 60 Å 的模拟盒中随机填充 1200 个 DME 分子和 120 个盐分子。Lennard-Jones 相互作用的截止距离选择为 1.1 nm。首先在两个模拟盒上执行共轭梯度能量最小化。在此点之后执行的 MD 模拟选择了 0.5 fs 的时间步长。首先在 300 K 下进行 5 ns 的等温等压系综模拟,以获得两个系统的正确体积。随后,使用规范系综模拟在室温下平衡两个系统另外 6 ns。规范系综模拟又持续了 10 ns,并且每 0.5 ps 获取一次模拟快照。使用 Python Materials Genomics (pymatgen) 包分析模拟的溶剂化结构48。径向密度函数和锂离子的扩散率是使用 MDAnalysis 软件包计算的49。
密度泛函理论 (DFT) 计算
使用DFT方法和Lee-Yang-Parr (LYP)非局域相关泛函(B3LYP)中的贝克三参数(B3)交换泛函进行量子化学计算50 , 51。所有几何优化均在 B3LYP/6-31 + G(d,p) 级别上执行。为了更准确的计算,能量计算在B3LYP/6-311 + +G(3df,3dp)级别进行。所有DFT计算均使用Gaussian 09程序包52进行。溶剂化结构形成能按下式计算:(3):
$${E}_{{{{{\rm{形式}}}}}}={E}_{{{{{\rm{簇}}}}}}-\sum {E}_{{{{{\rm{分子}}}}}}$$(3)
其中E簇是溶剂化结构的能量,E分子是形成溶剂化结构的所有分子的能量总和。
数据可用性
支持本文研究结果的数据可根据要求向通讯作者提供。
- 上一篇:探索世界上最古老的电池
- 下一篇:阴极氧化研究颠覆电池现状思考
